近日,我院杨朝勇教授等在低频突变核酸检测新方法领域取得重要研究进展,相关研究成果以“Sensitive and Accurate Detection of Low-frequency Mutations via Pyrophosphorolysis-Activated Selective Amplification and MALDI-TOF-MS Single-Nucleotide Resolution ldentification ”为题,发表于Journal of the American Chemical Society。
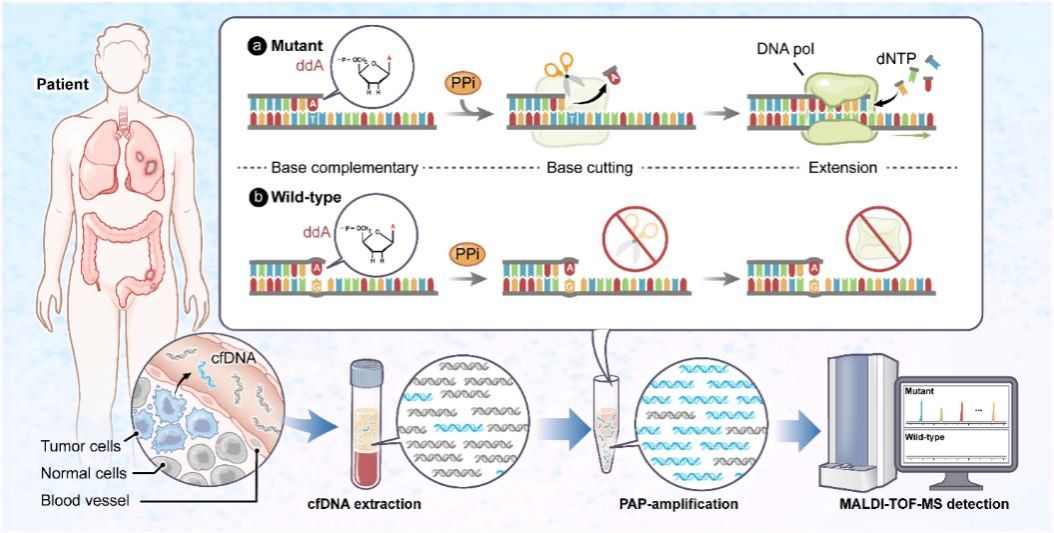
与需要手术或穿刺获取组织的传统活检相比,液体活检仅需抽取少量血液即可检测肿瘤释放的循环游离DNA(cfDNA),具有无创、可重复动态监测、能克服肿瘤异质性等优势,已成为精准医疗的重要工具。然而,液体活检技术的临床应用仍面临挑战:血液中绝大多数cfDNA来自正常细胞,肿瘤来源的DNA往往只占极低比例(可低至0.01%),传统检测方法如同“大海捞针”,难以在超高野生型背景中精准识别出这些低频突变。现有主流技术各有限制:扩增阻滞突变系统定量PCR(ARMS-qPCR)灵敏度不足,数字PCR(ddPCR)靶标检测通量有限,新一代测序技术在追求超高灵敏度和高检测通量的同时,面临成本高、周期长的难题。因此,发展兼具高灵敏度、高多重性及临床实用性的低频突变检测技术,仍是当前分子诊断领域的迫切需求。
基于此,本工作报道了一种能够在超高野生型核酸背景下实现低频突变高灵敏检测的新方法(HUNTER)。HUNTER通过将焦磷酸解激活聚合(PAP)反应的高选择性富集能力与基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)的高精度检测优势融合,构建了兼具高性能与临床实用性的液体活检新范式,为推进癌症精准诊疗的临床应用提供了强有力的技术支撑。该技术利用DNA聚合酶的焦磷酸解活性([dNMP]n + x[PPi] ⇌ [dNMP]n-x + x[dNTP]),通过在PAP引物3'端引入双脱氧核苷酸(ddNMP)作为阻断基团,确保引物仅在与突变模板完全互补时,通过焦磷酸解反应切除阻断基团并启动延伸扩增,从而实现对低频突变的高选择性富集。随后,通过MALDI-TOF-MS直接检测单碱基延伸产物的质荷比(m/z),实现单核苷酸分辨率的精准鉴定。该平台首创“选择性富集—质谱直接检测”一体化新策略,有效突破了低频突变在高背景野生型干扰下检测灵敏度不足的技术瓶颈,实现了检测灵敏度(0.01% 变异等位基因频率)、准确性(100%特异性)与多重检测能力(10个靶标)的协同突破。
该工作在我院杨朝勇教授、福建医科大学许醒副教授指导下完成,厦门大学博士研究生梁珊珊、硕士研究生宁宇与厦门大学附属第一医院吴晓婷主治医师为共同第一作者。该研究获得国家自然科学基金委项目、中元汇吉生物股份有限公司企业合作项目等支持。
论文链接:https://doi.org/10.1021/jacs.5c08741
